-
Par trichard le 18 Mars 2013 à 21:58
Avec la collaboration de Mathilde Girard, chargée de recherche en modélisation pathologique iPS à l’institut I-Stem à Evry.
Transformer une cellule adulte spécialisée en cellule immature capable de redonner n’importe quelle sorte de cellules de l’organisme ? Désormais, il ne s’agit plus d’un rêve de chercheur mais bien d’une réalité. Celle-ci a d’ailleurs valu le prix Nobel de médecine 2012 à Shinya Yamanaka, le chercheur japonais qui a mis au point la technique six ans plus tôt à l’université de Kobé.
La prouesse scientifique récompensée par le prix Nobel de médecine 2012 consiste à prélever pratiquement n’importe quelle cellule chez un adulte et à la reprogrammer génétiquement pour la rendre pluripotente, c’est à dire capable de se multiplier à l’infini et de se différencier en types de cellules qui composent un organisme adulte, exactement comme une cellule souche embryonnaire. Ces cellules sont appelées IPS pour cellules souches pluripotentes induites ("induced pluripotent stem cells").
On imagine déjà le potentiel énorme de ces cellules : facilement accessibles, et en quantité illimitée, elles pourraient permettre de régénérer des organes entiers.
En attendant, elles sont déjà largement utilisées pour modéliser de nombreuses pathologies et tester l’efficacité de molécules potentiellement thérapeutiques.
reportage Pr Yamanaka prix nobel de médecine... parTVFRANCEJAPONUn nouveau type de cellules souches
Des cellules souches sont naturellement présentes chez l’embryon et dans certains organes ou tissus adultes. Certaines cellules souches sont dites "pluripotentes" : elles peuvent se différencier en n’importe quel type de cellules de l’organisme, sans restriction. C’est le cas des cellules souches embryonnaires (ES). D’autres sont partiellement engagées dans une voie de différenciation, ce qui limite la variété des cellules spécialisées qu’elles pourront donner par la suite. C’est le cas des cellules souches adultes et des cellules souches issues de cordon ombilical.
Présentes lors des premiers stades du développement de l’embryon, les cellules souches embryonnaires sont relativement faciles à cultiver in vitro. Toutefois leur obtention passe par la destruction d’un embryon, ce qui pose un problème éthique. De ce fait, leur utilisation est actuellement interdite en France. Des dérogations permettant la réalisation de recherches dans des conditions extrêmement contrôlées peuvent toutefois être accordées par l’Agence de la Biomédecine.
Les cellules souches adultes proviennent de tissus qui se renouvellent. On en trouve par exemple dans la moelle osseuse où elles sont à l’origine des cellules sanguines (cellules souches hématopoïétiques), dans l’épiderme (cellules souches kératinocytaires) ou encore dans le tissu adipeux (cellules souches mésenchymateuses). Ces cellules sont présentes en faible quantité et moins faciles à cultiver que les cellules souches embryonnaires. Elles ne peuvent en outre produire que certains types de cellules différenciées, en fonction de leur tissu d’origine.
Les cellules IPS sont quant à elles identiques aux cellules souches embryonnaires, mais elles sont obtenues par reprogrammation génétique de cellules adultes différenciées. Depuis 2007, des centaines de lignées de cellules IPS ont été obtenues à partir de presque tous les types de cellules adultes capables de se multiplier.
Les cellules IPS en pratique
La reprogrammation de cellules différenciées en cellules IPS consiste à les modifier génétiquement pour réactiver les signaux d’immaturité et de prolifération caractéristiques d’une cellule pluripotente.
Pour cela quatre gènes surexprimés dans les cellules souches embryonnaires sont suffisants et nécessaires : Oct3/4, Sox2, c-Myc, et Klf4. Le gène c-Myc est notamment connu pour ses capacités à faire proliférer les cellules. Le fait de réactiver la pluripotence éteint les autres gènes de différenciation exprimés par la cellule.
La technique consiste à faire pénétrer ces quatre gènes dans la cellule adulte afin qu’ils s’y expriment.
Au début, les chercheurs utilisaient des vecteurs viraux qui avaient l’inconvénient majeur de s’intégrer dans le génome de la cellule hôte et entrainaient un risque de mutation et d’expression prolongée de ces gènes. Ces défauts sont désormais corrigés grâce à l’utilisation de nouveaux vecteurs non intégratifs : des plasmides ou encore le virus de Sendaï qui pénètrent dans la cellule puis finissent par se perdre au cours des divisions.
Des expériences de reprogrammation réduisant le nombre de gènes à introduire à trois, voire deux, ont été réalisées. Toutefois, le standard reste aujourd’hui l’introduction des quatre gènes utilisés par Shinya Yamanaka en 2006.
Toutes les cellules adultes qui prolifèrent peuvent être utilisées pour cette reprogrammation. Les fibroblastes cutanés sont les cellules les plus utilisées car elles sont faciles d’accès. Mais des essais concluants ont eu lieu avec bien d’autres type de cellules : kératinocytes (autres cellules de la peau), adipocytes, cellules hématopoïétiques (du sang)…
Les avantages des cellules souches embryonnaires, sans leurs inconvénients
Les cellules IPS ont les mêmes atouts que les cellules souches embryonnaires humaines : elles prolifèrent à l’infini et peuvent se différencier en tous les types de cellules de l’organisme. Mais elles ont des avantages supplémentaires: elles sont faciles d’accès, par simple biopsie chez l’adulte, et leur utilisation ne pose pas de problème éthique.
De plus, les cellules IPS peuvent provenir de donneurs sélectionnés pour leur patrimoine génétique. Cela permet de cultiver des cellules malades et de modéliser des pathologies pour les étudier. Autre intérêt dans le cadre de la médecine régénérative, il est possible de choisir un donneur compatible avec le receveur à traiter pour éviter un rejet de greffe.
Quelques bémols
Néanmoins, l’utilisation de ces cellules est très récente et pose encore un certain nombre de questions. Les scientifiques estiment par exemple que la reprogrammation n’est pas complète, dans le sens où des modifications du génome acquises au cours de la vie de la cellule persistent après la reprogrammation (modifications épigénétiques). Il est également légitime de se demander si la reprogrammation elle-même n’induit pas de mutations ou de modifications génétiques pouvant par la suite altérer le fonctionnement de ces cellules IPS.
Des modèles de maladies génétiques à foison
Les cellules IPS sont d’ores et déjà utilisées pour de la modélisation de pathologie : en prélevant des cellules d’un adulte porteur d’une maladie génétique, il est possible de les reprogrammer, de les faire proliférer, puis de les redifférencier dans le type de cellules qui exprime la maladie. Les chercheurs disposent alors d’une source illimitée de cellules malades pour étudier les mécanismes de la pathologie, tenter de corriger la mutation, tester des molécules thérapeutiques ou encore évaluer la toxicité d’un produit.
L’étape de re-différenciation est guidée in vitro par l’utilisation de facteurs de croissance adaptés. Elle est bien au point pour obtenir des cellules cardiaques, sanguines, du muscle lisse, des hépatocytes, des cellules rétiniennes ou encore des neurones. Toutefois, certaines lignées restent impossibles à recréer à ce jour. C’est par exemple le cas du muscle strié.
Des lignées de cellules IPS sont déjà disponibles pour étudier des dizaines de maladies comme la sclérose latérale amyotrophique, maladie de parkinson, le diabète de type 1, la maladie de Huntington, la trisomie 21, l’immunodéficience sévère combinée, le syndrome de Lesch-Nyhan, la maladie de Gaucher, le syndrome de Shwachman-Bodian-Diamond ou encore les dystrophies musculaires de Duchenne et de Becker.
© Inserm / Frédérique Koulikoff
Les cellules pluripotentes induites (IPS), pour étudier et traiter les maladies - Les IPS sont obtenues à partir de cellules adultes spécialisées, le plus souvent des cellules de la peau (1). Ces cellules sont génétiquement modifiées (2) pour redevenir immatures, semblables à des cellules souches embryonnaires. Le chercheur peut alors guider leur « re-différenciation » en cellules spécialisées de son choix (cellules cardiaques, hépatiques, rétiniennes, nerveuses…) (3) qui seront utilisées comme modèle d’étude (4) ou, dans le futur, comme cellules thérapeutiques (5).
Des chercheurs de l’Inserm et de l’Institut Pasteur ont par exemple réussi à corriger une mutation responsable d’une insuffisance hépatique dans des cellules IPS de patients malades. Ces cellules ont ensuite été redifférenciées en hépatocytes, puis injectées chez des souris présentant la pathologie. Les résultats ont été très encourageants : elles étaient parfaitement fonctionnelles et ont contribué à régénérer le foie malade des animaux.
Vers un premier essai clinique
L’autre application majeure des cellules IPS sera la thérapie cellulaire ou médecine régénérative. Les cellules ne pourront pas être utilisées telles qu’elles car elles induiraient la formation de tératomes, des masses de cellules qui prolifèrent et se différencient de façon anarchique en tous types cellulaires. Elles devront être pré-différenciées in vitro avant d’être injectées chez le malade, au niveau du site lésé, avec des facteurs de croissance ou des molécules favorables à leur implantation et leur différenciation.
Des essais de thérapie cellulaire utilisant des cellules souches adultes ou des cellules souches de cordon ombilical sont déjà en cours. Mais ces applications sont limitées par la quantité et la nature des cellules souches disponibles. Les cellules souches neurales adultes sont par exemple rares et très difficiles d’accès. Il n’est donc pas envisageable de traiter des maladies neurodégénératives par ce biais. Les cellules IPS permettront de contourner cette difficulté et apporteront des solutions aux problèmes ne pouvant pas être résolus par l’utilisation des cellules souches adultes.
© Inserm
Cure de jouvence pour cellules par Jean Marc Lemaitre
En ce qui concerne les essais de thérapie cellulaire utilisant des cellules pluripotentes, les chercheurs utilisent pour l’instant davantage les cellules souches embryonnaires, plus sûres sur le plan théorique. Ces dernières sont évaluées en cardiologie après un infarctus du myocarde, pour régénérer la rétine en cas de DMLA ou de dystrophie maculaire de Stargardt, dans les lésions traumatiques de la moelle épinière ou encore pour des pansements cutanés en cas d’ulcère chez les patients atteints de drépanocytose. Néanmoins, Shinya Yamanaka, le « père » des cellules IPS, a annoncé pour 2013 le lancement d’un premier essai utilisant des cellules IPS pour régénérer la rétine de patients atteints de DMLA. L’utilisation de ces cellules offre l’énorme avantage de pouvoir choisir le donneur en fonction de son patrimoine génétique pour prévenir un rejet de greffe par le receveur. A ce titre, le japonais constitue actuellement une banque de cellules IPS provenant de différents individus afin d’être en mesure de proposer aux malades les cellules les mieux tolérées.
 votre commentaire
votre commentaire
-
Par trichard le 3 Mai 2012 à 10:33
http://www2.cnrs.fr/presse/communique/2589.htm
Une nouvelle espèce de bactérie photosynthétique vient d'être mise en évidence : elle est capable de contrôler la formation de minéraux (carbonates de calcium, magnésium, baryum, strontium), à l'intérieur même de son organisme. Publiée dans Science le 27 avril 2012, une étude menée par des chercheurs français(1) révèle l'existence de ce nouveau type de biominéralisation dont le mécanisme est encore inconnu. Cette découverte a d'importantes implications pour l'interprétation du registre fossile ancien.
Les cyanobactéries focalisent depuis longtemps l'attention des scientifiques. Capables de photosynthèse(2), ces micro-organismes ont joué un rôle majeur dans l'histoire de la Terre, conduisant notamment à l'oxygénation de l'atmosphère. Certaines cyanobactéries sont capables de former des carbonates de calcium(3) à l'extérieur de leur cellule, notamment celles associées aux stromatolites, des roches carbonées qui datent d'environ 3,5 milliards d'années et comptent parmi les plus anciennes traces de vie sur Terre. Des cyanobactéries fossiles pourraient donc se retrouver au sein de ce type de formation. Pourtant, les premières cyanobactéries fossiles datent seulement de 700 millions d'années bien après le début de l'oxygénation de la Terre qui remonterait à 2,3 milliards d'années. Pourquoi un tel laps de temps ?
Une équipe française(1) vient peut-être d'apporter une réponse. Dans des stromatolites recueillis dans un lac de cratère mexicain et cultivés au laboratoire, les scientifiques ont mis en évidence une nouvelle espèce de cyanobactérie, baptisée Candidatus Gloeomargarita lithophora. Ce micro-organisme est issu d'une lignée qui a divergé précocement chez les cyanobactéries. Sa principale caractéristique : grâce à un mécanisme de biominéralisation encore inconnu, cette cyanobactérie fabrique des nanoparticules de carbonate de calcium intracellulaires, d'environ 270 nanomètres (soit 270 milliardièmes de mètres). Si l'on connaissait l'existence de cyanobactéries capables de former du carbonate de calcium extracellulaire au sein des stromatolites, c'est la première fois que l'on révèle une formation à l'intérieur de la cellule. Autre particularité de cette nouvelle espèce : elle accumule le strontium et le baryum pour l'incorporer aux carbonates.
Cette découverte a d'importantes implications pour l'interprétation du registre fossile ancien. En effet, si les cyanobactéries associées aux stromatolites formaient des carbonates à l'intérieur de leurs cellules et non pas à l'extérieur, elles n'auraient pas été préservées dans le registre fossile et pourraient expliquer le laps de temps entre leur apparition (il y a au moins 2,3 milliards d'années) et les plus vieux fossiles retrouvés (il y a 700 millions d'années). Reste désormais à découvrir pourquoi et comment cette cyanobactérie fabrique ce carbonate de calcium.
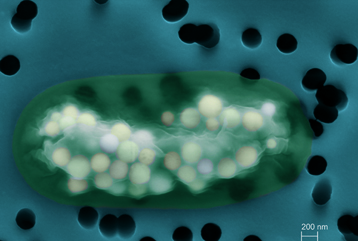
© Karim Benzerara & Stefan Borensztajn
Image de Candidatus Gloeomargarita lithophora. On distingue à l'intérieur de la cyanobactérie les inclusions de carbonates de calcium, magnésium, strontium et baryum.
Notes :
(1) L'équipe est composée de chercheurs de l'Institut de minéralogie et de physique des milieux condensés (CNRS/UPMC/Université Paris Diderot/IPGP/IRD), du Laboratoire écologie, systématique et évolution (CNRS/Université Paris-Sud), du Laboratoire de minéralogie et de cosmochimie du Muséum (Muséum national d'Histoire naturelle/CNRS), de l'Institut de Physique du Globe de Paris (CNRS/IPGP/Université Paris Diderot), en collaboration avec l'Université de Stanford aux Etats-Unis.
(2) La photosynthèse permet aux cyanobactéries de capter l'énergie lumineuse grâce à des pigments pour produire de la matière organique à partir du dioxyde de carbone en libérant du dioxygène comme produit de déchet.
(3) Constitutif de la craie, du calcaire et du marbre, le carbonate de calcium compose les coraux, les coquilles d'escargots ou d'animaux et les stromatolites.Références :
An Early-Branching Microbialite Cyanobacterium Forms Intracellular Carbonates, Estelle Couradeau, Karim Benzerara, Emmanuelle Gérard, David Moreira, Sylvain Bernard, Gordon E. Brown Jr., Purificación López-García – Science, 27 avril 2012
 votre commentaire
votre commentaire
-
Par trichard le 4 Avril 2012 à 10:54DÉVELOPPEMENT | 07.03.2012

Les cellules souches embryonnaires des primates n’ont pas les mêmes propriétés que celles des souris.Prélevées dans des embryons de 5 à 6 jours appelés blastocystes, les cellules souches embryonnaires (ES) sont pluripotentes : elles sont capables de se différencier en n’importe quel type cellulaire de l’organisme. Avec leur capacité à s’autorenouveler indéfiniment, c’est même leur principale caractéristique. Mais l’équipe de Shoukhrat Mitalipov, du Centre national de recherche sur les primates de l’Oregon, aux États-Unis, vient de montrer que les cellules ES de primates ne correspondent pas parfaitement à cette définition [1] .
À la tête d’une des rares équipes travaillant sur les cellules ES de singes, Shoukhrat Mitalipov a voulu les soumettre au test ultime prouvant leur pluripotence en les injectant dans des blastocystes intacts. Soumises à ce test, des cellules ES sont en effet censées s’associer à celles du blastocyste, et contribuer à la formation de tous les tissus de l’organisme. On obtient alors un animal chimère, comme l’ont montré nombre d’expériences de ce type menées chez la souris.
Foetus examinés
L’équipe de biologistes a donc prélevé des cellules ES dans des blastocystes de macaque, les a mises en culture pour en obtenir une quantité plus importante, puis les a injectées dans 26 blastocystes intacts. Les embryons ainsi obtenus ont ensuite été transférés dans l’utérus de 7 femelles. Quatre d’entre elles ont entamé une gestation. Au bout de 82 jours, leurs foetus ont été examinés.
Les chercheurs s’attendaient que les tissus de ces animaux soient un mélange de cellules dérivant des cellules ES injectées et des cellules du blastocyste. Mais ce ne fut pas le cas. Aucune chimère parmi les 7 foetus étudiés ! Même échec en changeant quelque peu le protocole, et en injectant les cellules ES immédiatement après les avoir prélevées.
« Ces résultats vont dans le même sens que d’autres obtenus depuis 3 ans sur des cellules ES de primates en culture, explique Pierre Savatier, de l’institut cellules souches et cerveau de l’Inserm, à Bron. Dans mon laboratoire, nous avons par exemple constaté qu’elles ne s’autorenouvellent pas aussi bien que les cellules ES de souris. » Qu’en déduire ? Que les cellules ES de primates sont légèrement plus avancées dans leur développement que les cellules ES de souris, et que l’on ne peut pas directement extrapoler aux premières les résultats obtenus avec les secondes.
Maigre consolation : dans une ultime expérience, l’équipe de Shoukhrat Mitalipov a tout de même réussi à obtenir les premiers macaques chimères au monde, mais pas en utilisant des cellules ES. Les biologistes de l’Oregon ont recouru à une méthode très classique consistant à fusionner plusieurs embryons âgés de deux jours, stade auquel ils sont composés de seulement 4 cellules. Ces embryons fusionnés se sont développés en blastocystes, qui ont été transférés chez cinq femelles. Deux ont poursuivi leur grossesse à terme, donnant naissance à trois petits mâles. Le biologiste l’a vérifié : il s’agit bien de chimères.
Olivier Donnars
[1] M. Tachibana et al., Cell, 148<, 285, 2012.
 votre commentaire
votre commentaire
-
Par trichard le 3 Novembre 2011 à 22:33
http://www2.cnrs.fr/presse/communique/2335.htm
L'équipe AVENIR Inserm "Plasticité génomique et vieillissement" dirigée par Jean Marc Lemaitre, chargé de recherche Inserm à l'Institut de génomique fonctionnelle (Inserm/CNRS/Université de Montpellier 1 et 2), vient de parvenir à rajeunir des cellules de donneurs âgés, vieilles de plus de 100 ans. Ces cellules âgées, reprogrammées in vitro en cellules souches pluripotentes (iPSC pour "Induced pluripotent stem cells") ont retrouvé leur jeunesse et les caractéristiques des cellules souches embryonnaires (hESC): elles peuvent se différencier à nouveau en cellules de tous types après une véritable cure de "jouvence". Ces résultats constituent une avancée significative pour la recherche sur les cellules iPSC et une nouvelle étape vers la médecine régénérative.
Les résultats sont publiés dans la revue Genes & Development datée du 1er novembre 2011.Les cellules souches embryonnaires humaines (hESC) sont des cellules "à tout faire" qui sont indifférenciées. Par leurs divisions, elles assurent la mise en place de toutes les cellules adultes différenciées de l'organisme (neurones, cellules cardiaques, cellules de peau, cellules du foie…cf. figure 1).
Depuis 2007, quelques équipes de recherche dans le monde sont capables de reprogrammer des cellules adultes humaines en cellules souches pluripotentes (iPSC), qui présentent des caractéristiques et un potentiel similaires aux cellules souches embryonnaires humaines (hESC). Cette reprogrammation (cf. figure 1 en rouge), offre la possibilité de reformer tous les types cellulaires de l'organisme en dehors des contraintes éthiques liées à l'utilisation de cellules souches de type embryonnaires.
Jusqu'alors, les résultats de recherches publiés montraient que la sénescence, point ultime du vieillissement cellulaire, restait une limite à l'utilisation de cette technique pour des applications thérapeutiques chez des patients âgés.
Aujourd'hui, Jean Marc Lemaitre, chargé de recherche à l'Inserm et son équipe, viennent de franchir cette limite. Les chercheurs sont parvenus à rajeunir des cellules de donneurs âgés, jusqu'à plus de 100 ans, et ont ainsi démontré la réversibilité du processus du vieillissement cellulaire.
Pour ce faire, ils ont utilisé une stratégie adaptée qui consiste à reprogrammer des cellules, grâce à un "cocktail" spécifique de 6 facteurs génétiques tout en effaçant les marques du vieillissement. Les chercheurs ont montré que les cellules souches iPSC obtenues ont alors la capacité de reformer tous les types cellulaires de l'organisme. Elles possèdent des caractéristiques physiologiques de cellules "jeunes", tant du point de vue de leur capacité proliférative que de leur métabolisme cellulaire.
Un cocktail de 6 facteurs génétiques…
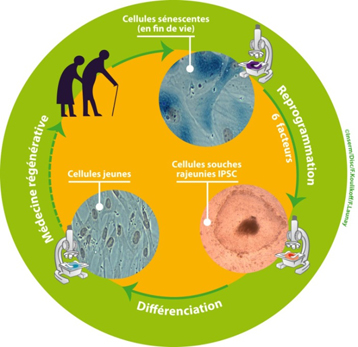
Les chercheurs ont d'abord multiplié des cellules de la peau (fibroblastes) d'un donneur de 74 ans pour atteindre la sénescence caractérisée par l'arrêt de la prolifération des cellules. Ils ont ensuite procédé à la reprogrammation in vitro de ces cellules. Dans cette étude, Jean Marc Lemaitre et son équipe ont d'abord confirmé que cela n'était pas possible avec le lot de 4 facteurs génétiques classiquement utilisé (OCT4, SOX2, C MYC et KLF4) et ont ajouté 2 facteurs supplémentaires (NANOG et LIN28) qui ont permis de franchir cette barrière (cf. figure 2).
Grâce à ce nouveau "cocktail" de 6 facteurs, les cellules sénescentes, reprogrammées en cellules souches pluripotentes iPSC fonctionnelles, réacquièrent les caractéristiques de cellules souches pluripotentes de type embryonnaire.
En détail, elles ont retrouvé leur capacité d'autorenouvellement et leur potentiel de différenciation d'antan, ne conservant aucune trace de leur vieillissement antérieur.
Pour vérifier les caractéristiques "rajeunies" de ces cellules, les chercheurs ont testé le processus inverse. Les cellules iPSC rajeunies ont été à nouveau différenciées en cellules adultes (cf. figure 1) et comparées aux cellules âgées d'origine ainsi qu'à celles obtenues à partir de cellules souches pluripotentes de type embryonnaires (hESC).
"Les marqueurs de l'âge des cellules ont été effacés et les iPSC, que nous avons obtenues peuvent produire des cellules fonctionnelles, de tous types avec une capacité de prolifération et une longévité accrues", explique Jean Marc Lemaitre qui dirige l'équipe AVENIR de l'Inserm.
...testé sur des cellules âgées de plus de 100 ans
Les résultats obtenus ont conduit l'équipe de recherche à tester le cocktail sur des cellules plus âgées de 92, 94, 96 jusqu'à 101 ans. "Notre stratégie a fonctionné sur les cellules de centenaires. L'âge des cellules n'est définitivement pas une barrière à la reprogrammation", conclut-il. "Ces travaux ouvrent la voie à l'utilisation thérapeutique des iPS à terme, en tant que source idéale de cellules adultes tolérées par le système immunitaire, pour réparer des organes ou des tissus chez des patients âgés", ajoute le chercheur.
Ce travail a fait l'objet d'une demande de brevet auprès d'Inserm Transfert.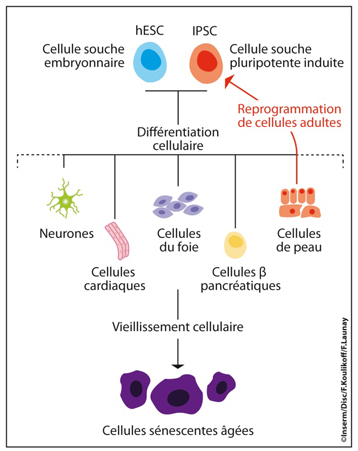
© Inserm/Disc/F.Koulikoff/F.Launay
Figure 1 : Différenciation cellulaire
© Inserm/Disc/F.Koulikoff/F.Launay
Figure 2 : Reprogrammation de cellules sénescentes âgées
Références :
Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state
Lapasset, L. (1), Milhavet, O. (2), Prieur, A. (1), Besnard, E. (1), Babled, A. (1), Aït-Hamou, N. (1), Leschik, J. (1), Pellestor, F. (4), Ramirez, JM. (3), De Vos, J. (3), Lehmann, S. (2), Jean-Marc Lemaitre (1).
1- Laboratory of Plasticity of the Genome and Aging, Institute of Functional Genomics, 141 rue de
la Cardonille, 34094 Montpellier Cedex 05, France
2- Laboratory of Neurological Disorders and Stem Cells, Institute of Human Genetics, 141 rue de
la Cardonille, 34396 Montpellier Cedex 05, France
3- Laboratory of Early Embryo Development and Human Pluripotent Stem Cells, Institute for
Research in Biotherapy, CHU Saint-Eloi Hospital, 80 avenue Augustin Fliche, 34295 Montpellier
Cedex 05, France
4- Laboratory of chromosomal Genetics, Medical Genetics Department Hôpital CHRU Arnaud de
Villeneuve, 371 avenue du Doyen Gaston Giraud, 34295 Montpellier cedex 5, France
Genes & Development, 1er novembre 2011. Vol. 25, No. 21, doi:10.1101/gad.173922.111 votre commentaire
votre commentaire
-
Par trichard le 9 Mai 2011 à 16:31
http://www.larecherche.fr/content/actualite-vie/article?id=29811
Les bactéries communiquent grâce à des nanotubes

Des bactéries d’espèces différentes échangent des protéines et de l’ADN via des nanotubes. La découverte pourrait bouleverser l’approche des interactions bactériennes.Les bactéries ne cessent d’interagir les unes avec les autres. Par exemple, en libérant des molécules qui agissent comme des signaux sur les bactéries voisines. Ou encore, en entrant en contact grâce à un pilus, un tube protéique très fin qui permet le passage d’ADN.
Mais le mode de communication que viennent de découvrir Sigal Ben-Yehuda et Gyanendra Dubey, de l’université hébraïque de Jérusalem, est très différent : il s’agit de larges tubes membranaires capables de véhiculer non seulement de l’ADN, mais aussi de grosses protéines [1] . Une découverte qui, si elle est confirmée par d’autres équipes, constituerait une forme de communication totalement nouvelle.
« C’était accidentel », raconte Sigal Ben-Yehuda. En scrutant des bactéries Bacillus subtilis placées sur son microscope à fluorescence, la chercheuse fait une observation surprenante : certaines bactéries, modifiées génétiquement pour exprimer une protéine fluorescente nommée GFP, semblent transmettre leur brillance à leurs voisines, qui, elles, ne possèdent pas le gène de la GFP.
Intriguée, elle met au point une série d’expériences destinées à comprendre ce phénomène. Elle constate que des bactéries fixées sur des supports solides construisent entre elles des nanotubes capables de transférer de grosses protéines comme la GFP, ainsi que de l’ADN. Qui plus est, ce type d’échange a lieu même entre bactéries d’espèces différentes, par exemple Bacillus subtilis et Staphylococcus aureus. Les images en microscopie électronique montrent de multiples connexions tubulaires entre bactéries voisines, de 30 à 130 nanomètres de large et d’environ un micromètre de long. Des connexions à l’intérieur desquelles on peut même détecter des molécules de GFP préalablement marquées.
La chercheuse s’interroge : ces tunnels peuvent-ils véhiculer des protéines de résistance aux antibiotiques ? Avec Gyanendra Dubey, elle cultive deux lignées bactériennes, l’une résistante à l’antibiotique chloramphenicol, l’autre à la lyncomycine. Mises en présence des deux antibiotiques, les deux lignées survivent si elles sont cultivées ensemble, alors que séparément, elles s’éteignent.
Molécules de résistance
C’est la preuve qu’elles se transmettent l’une l’autre des molécules leur permettant de résister de façon transitoire. Pour Philippe Noirot, spécialiste de génétique microbienne à l’Institut national de la recherche agronomique : « Si ce phénomène est aussi général que les auteurs le suggèrent, il expliquerait des résistances aux antibiotiques observées chez des bactéries qui n’ont pourtant pas le matériel génétique nécessaire. C’est une découverte stimulante. »
La publication, accueillie avec un enthousiasme teinté de prudence, suscite de nombreuses questions. Le transport de protéine est-il passif ou actif ? Unidirectionnel ou bidirectionnel ? Les bactéries choisissent-elles leur partenaire ? Quelles substances sont véhiculées ? À Jérusalem, Sigal Ben-Yehuda tente désormais de déterminer les bases génétiques des nanotubes et de visualiser en temps réel le transfert de protéines d’une bactérie à l’autre.
Anne Debroise
http://www.cell.com/retrieve/pii/S009286741100016X

Cell, Volume 144, Issue 4, 590-600, 18 February 2011
Copyright © 2011 Elsevier Inc. All rights reserved.
10.1016/j.cell.2011.01.015Highlights
- Intercellular nanotubes bridge neighboring bacterial cells
- Cytoplasmic molecules are exchanged between neighbors via nanotubes
- Cells acquire new hereditary and nonhereditary features by molecular exchange
- Nanotubes provide a network for molecular exchange within and between species
Summary
Bacteria are known to communicate primarily via secreted extracellular factors. Here we identify a previously uncharacterized type of bacterial communication mediated by nanotubes that bridge neighboring cells. Using Bacillus subtilis as a model organism, we visualized transfer of cytoplasmic fluorescent molecules between adjacent cells. Additionally, by coculturing strains harboring different antibiotic resistance genes, we demonstrated that molecular exchange enables cells to transiently acquire nonhereditary resistance. Furthermore, nonconjugative plasmids could be transferred from one cell to another, thereby conferring hereditary features to recipient cells. Electron microscopy revealed the existence of variously sized tubular extensions bridging neighboring cells, serving as a route for exchange of intracellular molecules. These nanotubes also formed in an interspecies manner, between B. subtilis and Staphylococcus aureus, and even between B. subtilis and the evolutionary distant bacterium Escherichia coli. We propose that nanotubes represent a major form of bacterial communication in nature, providing a network for exchange of cellular molecules within and between species.
Authors
 votre commentaire
votre commentaire Suivre le flux RSS des articles de cette rubrique
Suivre le flux RSS des articles de cette rubrique Suivre le flux RSS des commentaires de cette rubrique
Suivre le flux RSS des commentaires de cette rubrique
Mon petit cahier de sciences naturelles





