-
La fusion des cellules musculaires survient durant le développement des
muscles squelettiques et, chez l'adulte, lors de l'adaptation du muscle
adulte à un traumatisme musculaire ou à un exercice physique intense.
Au cours de ces différents processus, les cellules myogéniques
mononucléées (myoblastes ou cellules satellites) sont activées,
prolifèrent, se différencient et fusionnent, entraînant la formation et
l'hypertrophie des cellules musculaires plurinucléées (myofibres) (Figure 1).
Les myofibres sont des composantes essentielles des muscles
squelettiques qui permettent la contraction musculaire. Par conséquent,
la régulation de leur taille est nécessaire au bon fonctionnement du
muscle squelettique. À ce jour, plusieurs facteurs de croissance, dont
l'IGF-1 (insulin-like growth factor-1), et l'HGF (hepatocyte growth factor),
ont été impliqués dans le processus d'activation des cellules
myogéniques. Toutefois, la fusion des cellules myogéniques est un
processus plus complexe qui requiert l'orchestration d'une série
d'événements cellulaires comme la migration des cellules, leur
alignement, leur reconnaissance, leur adhérence, et enfin, la fusion
membranaire. À l'heure actuelle, les mécanismes moléculaires qui
contrôlent ces processus de fusion myogénique sont peu connus.
Cependant, une partie de ce puzzle vient d'être découverte. En effet,
une récente publication implique la voie de signalisation de NFATc2 (nuclear factor of activated T cells) dans l'activation du gène de l'interleukine-4 (IL-4) et la fusion des cellules musculaires.
 votre commentaire
votre commentaire
-
La fabuleuse capacité de régénération de la salamandre et du triton ne
constitue certainement pas une exception parmi les êtres
multicellulaires, métazoaires et métaphytes. Chez les vertébrés, chacun sait que le lézard peut, lui aussi, faire le sacrifice de la queue par laquelle tentent de l'attraper les enfants, puis la régénérer.
Certains poissons ont, en ce domaine, également de la ressource. Le poisson zèbre, par exemple, peut efficacement réparer des nageoires largement amputées. Chez les invertébrés, la capacité de régénérer des parties du corps est très fréquemment observée, chez les crustacés, les insectes, les mollusques, les annélides, les planaires et les cnidaires tels que l'hydre.Dans ces deux derniers embranchements animaux, la capacité régénérative
est même prodigieuse. Ainsi, un plathelminthe coupé en plusieurs
centaines de fragments engendrera, quelques semaines après, autant de
vers complets. Chez les cnidairs, l'hydre peut, comme nous le rappelle
la mythologie, tout régénérer, en particulier la tête
Pearson H. The regeneration gap. Nature 2001; 414: 388-90. - Brockes
JP, Kumar A. Plasticity and reprogramming of diffentiated cells in
amphibian regeneration. Nat Rev Mol Cell Biol 2002; 3 : 566-74.Quant au monde végétal, la capacité de régénération y est générale et considérable .
Par conséquent, les piètres performances régénératives des mammifères,
des oiseaux et de la plupart des poissons font figure d'exception dans
le monde vivant, et non point de règle. Les mécanismes qui président au
processus de régénération sont de deux types. Chez les hydres et les
plathelminthes persiste une population de véritables cellules souches
totipotentes qui sont recrutées en cas de lésion et se différencient
alors pour régénérer la structure éliminée. En revanche, de telles
cellules souches ne semblent pas persister dans le modèle des
amphibiens urodèles. Ici, les cellules à proximité de la zone lésée,
en particulier les fibres musculaires, commencent à se dé-différencier
pour former un blastème régénératif contenant des progéniteurs
mésenchymateux.
C'est aux dépens de cette structure que sont régénérés la queue ou les
membres absents. La régénération chez les plantes a plus de points
communs avec le modèle des amphibiens qu'avec celui des hydres et des
vers. En effet, n'importe quelle cellule somatique végétale, notamment des cellules de feuilles, a la possibilité, dans des conditions de culture et de stimulation
hormonale particulières, de se dédifférencier pour former un cal
embryoïde et régénérer une plante entière. Tel est le principe à la
base des techniques de clonage végétal et de fabrication de plantes transgéniques.
Il apparaît que, pour l'essentiel, la plupart des vertébrés et tous les
mammifères ont perdu la plus grande partie de leur remarquable capacité
régénérative. L'homme, en particulier, peut perdre la tête, au sens
propre comme au sens figuré. Ce n'est que dans cette seconde acception
que, parfois, il la retrouve.
Cependant, le tableau n'est pas si noir comme le montrent les
remarquables capacités à régénérer du foie qu'illustre le mythe de
Prométhée, ou bien du système hématopoïétique qui permet aux malades en
aplasiemédullaire thérapeutique de guérir. Personne ne doutait donc qu'existaient des cellules progénitrices spécifiques d'organes ou de lignages cellulaires,
impliquées dans ces processus régénératifs. D'autres tissus semblaient
plus rebelles, voire totalement réfractaires à tout phénomène de
réparation. Ainsi en était-il, par exemple, du cœur et du système
nerveux central.
L'utilisation de l'imparfait est ici de rigueur car les preuves
abondent aujourd'hui que persistent chez l'adulte des cellules souches
neurales Kahn A. Cellules souches et médecine régénératrice. Med Sci 2002 ; 18 : 503-9.. Si le rôle de ces dernières dans les processus physiologiques ou pathologiques chez l'homme reste discuté, elles peuvent néanmoins être isolées et constituent ainsi un matériel potentiel de thérapie
cellulaire. L'incapacité du cœur des mammifères à régénérer est un
dogme qui vient lui-même d'être remis en question par l'observation
d'une lignée particulière de souris (souris MRL)Leferovich JM, Bedelbaeva K, Samulewicz S, et al. Heart regeneration in adult MRL mice. Proc Natl Acad Sci USA 2001 ; 98 : 9830-
Dans ce cas, on ne sait pas encore si cette capacité régénérative est
liée à la mobilisation de progéniteurs indifférenciés, qu'ils soient
spécifiques du cœur ou pluripotents, ou bien, plus probablement et
selon le même schéma que pour les amphibiens urodèles, à la
dé-différenciation de cardiomyocytes. Cette dernière éventualité n'est
pas si baroque qu'il y paraît. En effet, l'activation conditionnelle
d'un transgène
msx1 dans des myotubes murins différenciés conduit ceux-ci à se
fragmenter pour engendrer des progéniteurs mésodermiques qui peuvent,
en fonction des conditions de culture, redonner soit du muscle, soit du
tissu adipeux, de l'os ou du cartilage Odelberg S, Kollhoff A, Keating MT. Dedifferentiation of mammalian myotubes induced by msx1. Cell 2000 ; 103: 1099-109..
Il s'agit là d'un phénomène très proche de la cellularisation,
dé-différenciation et prolifération des myotubes de salamandres et de
tritons à proximité du plan de section d'un membre.
Reste que la régénération d'une structure complexe, pluri-tissulaire
n'est plus possible chez les animaux àsang chaud, le secret semblant en
avoir été perdu au cours de l'Évolution. La cause de cette incapacité
régénérative pouvait être recherchée dans l'absence, chez ces animaux
supérieurs, de cellules souches pluripotentes persistant tout au long
de la vie, ou dans une limitation du niveau possible de
dé-différenciation.
Pourtant, la multiplication des expériences de clonage de mammifères par transfert nucléaire de noyaux somatiques dans des ovocytes énucléés, démontre que le génome
cellulaire reste d'une étonnante plasticité, même dans une cellule
totalement différenciée. Dans ce cas, cependant, une machinerie
germinale - le cytoplasme
de l'ovocyte - est impliquée, et l'on pouvait penser qu'aucun
équivalent n'en persistait dans des cellules somatiques. Cette
interprétation est certainement remise en question par tout un faisceau
de publications par des équipes américaines et européennes Stewart
R, Przyborskis. Non-neural adult stem cells: tools for brain repair?
BioEssay 2002; 24: 708-14.Orkin SH, Morrison SJ. Stem-cell competition.
Nature 2002; 418: 25-7.
Le laboratoire de Catherine Verfaillie dans le Minnesota est probablement le plus actif dans l'exploration de cette voie Jiang
Y, Jahagirdar BN, Reinhardt RL, et al.Pluripotency of mesenchymal stem
cells derived from adult marrow. Nature 2002; 418: 41-9.. Ces
résultats récents, qui créent une effervescence légitime dans la
communauté scientifique aussi bien que dans le grand public, nous
apprennent que l'on peut isoler de divers tissus animaux, en
particulier de la moelle osseuse,
des cellules souches pluripotentes aux étonnantes capacités rappelant
celles des cellules souches embryonnaires. Dans différentes
expériences, la capacité de ces cellules à participer au développement
embryonnaire et fœtal et, chez l'adulte, au repeuplement de la plupart
des organes, a été démontrée. Un autre avantage potentiellement
essentiel de ces cellules par rapport aux cellules souches
embryonnaires est qu'elles ne sont pas tumorigènes. Il est possible de
les injecter ou de les greffer à un organisme adulte sans dommage alors
que, dans les mêmes conditions, des cellules ES indifférenciées
engendreraient des tératocarcinomes.2°) Réflexions sur la salamandre
Il semble donc que persiste chez les mammifères, y compris Homo sapiens,
un potentiel régénératif bien plus important qu'on ne le craignait. En
cela, l'homme peut-il être plutôt comparé à l'hydre ou à la salamandre?
En d'autres termes, ces cellules souches somatiques,
que Catherine Verfaillie appelle les progéniteurs adultes multipotents,
pré-existent-ils, comme chez les plathelminthes ou les hydres, ou
sont-ils engendrés en réponse à des stimulus régénératifs?
En fait, il n'est à ce jour pas possible de répondre à cette question,
encore que je ferais bien le pari que notre ressemblance avec la
salamandre l'emporte sur celle avec l'hydre. S'il en est bien ainsi,
l'on peut craindre que les progrès escomptés dans la maîtrise de ce
processus ne permettent pas aisément de transformer la décapitation en
un processus réversible. Mon sentiment vient des conditions dans
lesquelles apparaissent les MAPC (multipotent adult progenitor cells)
de Catherine Verfaillie. Ce n'est qu'après environ 4 semaines de mise
en culture de cellules indistinguables des progéniteurs mésenchymateux,
et environ 25 doublements, qu'apparaissent ces cellules aux étonnantes
capacités. Ce phénomène est à rapprocher de la dé-différenciation à
l'origine de la constitution du blastème régénératif des amphibiens,
structure dans laquelle les progéniteurs mésenchymateux semblent
justement jouer un rôle essentiel.
Au total, il apparaît que nous n'en sommes encore qu'aux balbutiements
de cette exploration des phénomènes persistants de régénération chez
les mammifères, l'homme en particulier. Les questions fondamentales et
pratiques restent innombrables. Quel rôle jouent, en physiologie et en pathologie,
ces cellules souches somatiques multipotentes ? Pré-existentelles, ou
bien sont-elles engendrées par un processus de dé-différenciation à
partir d'une population de type mésenchymateux? Leur nombre potentiel -
ou bien la capacité de les obtenir à partir d'une population
mésenchymateuse - décroît-il au cours de la vie? Dans ce cas, ce
phénomène intervient-il dans la sénescence?
Serait-il en pratique possible d'isoler de telles cellules chez des
adultes malades, et de les utiliser chez eux à des fins de médecine
régénératrice? Ou bien, la préparation de telles populations à des fins
thérapeutiques étant longue et difficile, de plus en plus incertaine à
mesure que vieillissent les donneurs, faudra-t-il envisager d'en garder
en réserve à partir de prélèvements systématiques effectués précocement
dans la vie?
Les quelques observations selon lesquelles de telles cellules
pourraient répondre à des signaux en provenance des tissus lésés afin
de s'y domicilier et de les régénérer seront-elles confirmées, et dans
ce cas ce phénomène sera-t-il généralisable à tous les organes?
Quel sera, dans l'avenir, le champ des maladies accessibles à la thérapie
cellulaire régénératrice, et quelle part respective joueront alors les
cellules souches embryonnaires et les cellules souches somatiques
multipotentes ?
Autant de questions auxquelles nous ne pourrons apporter de réponses
que progressivement. En attendant, les informations acquises permettent
déjà d'affirmer que nous avons, en quelques années, changé de paradigmeKuhn T. The structure of scientific revolutions. Chicago: Chicago University Press, 1962.
en ce qui concerne notre vision de la différenciation cellulaire et de
sa plasticité; et aussi, que ce nouveau paradigme élargit
considérablement les perspectives de la thérapie cellulaire et fonde
l'espoir de l'émergence d'une véritable médecine régénératrice.http://www.futura-sciences.com/comprendre/d/dossier224-3.php
 7 commentaires
7 commentaires
-
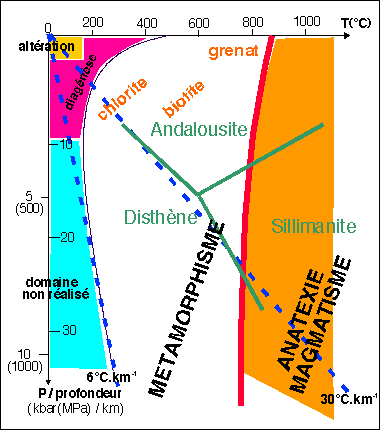
métamorphisme prograde : P°+T° augmentent
métamorphisme retrograde : P°+T° diminuent
Les réactions chimiques se déroulant au niveau des minéraux sont très lentes, mais leur vitesse augmente avec la
température :- Quand le métamorphisme est prograde (P et T augmentent), les réactions s'accélèrent et les équilibres chimiques peuvent être atteints relativement rapidement (à l'échelle des temps géologiques bien sûr!!).
- Quand le métamorphisme est rétrograde (P et T diminuent), les réactions ralentissent jusqu'à devenir infiniment lentes (métastabilité).
L'eau libérée par les réactions du métamorphisme prograde (sens 1) a tendance à migrer vers la surface. De ce fait, lorsque P et T diminuent, cette eau n'est plus disponible pour reconstituer des minéraux hydratés (sens 2) : les minéraux formés en profondeur persistent donc à l'état métastable jusque dans les conditions de la surface.
http://www.pierron.fr/ressources/notices/MT18622_2.pdf


 votre commentaire
votre commentaire
-
sub [lat, sub : sous, pas tout à fait, un peu, presque]
ophitique [grec ophis : serpent] : dolérite à structure poecilitique particulière : grd cistaux de px englobant des petites lattes de plagioclases
poecilitique [grec poikilos : varié] : gd cristal d'un minéral contenant de nbx petits cristaux d'un autre minéral
La structure ophitique se rencontre dans des roches magmatiques, comme
la dolérite, avec, ce qui caractérise cette structure, des cristaux de
pyroxènes, le plus souvent cpx, englobant de petits cristaux de
plagioclase. Dans une structure subophitique, cpx et plagioclases sont de taille similaire. Ces
structures se rencontrent notamment dans les dolérites, roches
filoniennes, mises en place plus profondément qu'un basalte, mises en
place attestées par leur structure microcristalline, sans verre.
Quelquefois, appelées microgabbros ou microdiorites, les dolérites
forment les roches filoniennes de la couche 2 de la croûte océanique et
les soubassements d'édifices volcaniques. Ces derniers, dégagés par
l'érosion, forment de grandes dalles plates bleu-vert, utilisées
notamment pour les constructions mégalithiques dans tout l'ouest de
l'Europe.

 votre commentaire
votre commentaire
Mon petit cahier de sciences naturelles





