-
http://www.biodeug.com/cours/ba6.php
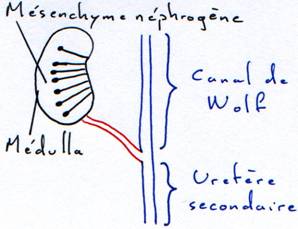
La formation du canal de Wolf (ou uretère primaire).
A partir d'une ébauche de mésenchyme antérieur dorsal
se forme un canal qui progresse vers l'arrière dorsalement jusqu'au
cloaque où il va déboucher. La formation de ce canal précède la mise en
place des néphrons.Le canal de Müller.
Dorsalement,
à l'arrière du cou, la cavité cœlomique donne une expansion vers
l'extérieur. Ce canal débute par un entonnoir qui prolifère vers
l'arrière parallèlement au canal de Wolf.Ce canal est le gonoducte : le tractus génital femelle.
La formation des gonades.
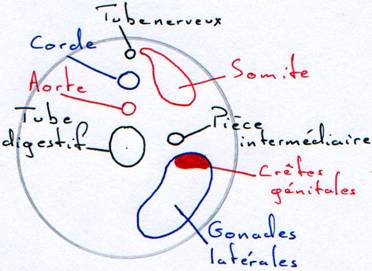
Les crêtes génitales pendent dans la cavité générale par un
mésenchyme. Des cellules endodermiques viennent coloniser cette crête.
Elles donneront les gamètes.Pour le mâle.
Le cortex régresse. La medulla se développe. Elle se creuse de tubes (séminifères). Qui convergent et entre en relation avec des néphrons dont le glomérule ne se développe pas.
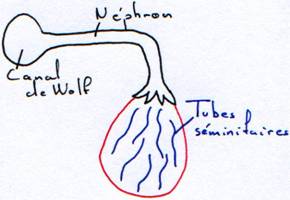
On a maintenant une relation entre les appareils urinaire et génital. Le canal de Wolf acquiert une nouvelle fonction : c'est un canal uro-génital.
On assiste à la dégénérescence du canal de Müller.
Les testicules sont drainés par des néphrons modifiés et se déversent dans le canal de Wolf.
L'apparition du métanéphros met en place les uretères secondaires.
è Le canal de Wolf devient exclusivement génital : on parle de spermiducte. On a une séparation complète des deux appareils.
Le canal de Wolf se pelotonne la surface du testicule pour former l'épididyme.
Pour la femelle.
On a une hypertrophie du cortex et une disparition de la medulla. Les cellules vont se différencier en gamètes : les ovaires restent totalement distincts de l'appareil excréteur.
Les ovules sont excrétés dans la cavité abdominale puis captés par le canal de Müller et transmis aux trompes de Fallope.
L'urine du métanéphros est récupérée par les uretères secondaires : le canal de Wolf régresse.
Les
ovules pondus sont récupérés par le canal de Müller. Avec la
placentation, la paroi de ce canal devient musculaire, se différencie
pour former un utérus.A l'origine, chaque oviducte est touché par cette transformation.
 1 commentaire
1 commentaire
-
http://svt.prepabac.s.free.fr/images/chicxulub.jpg
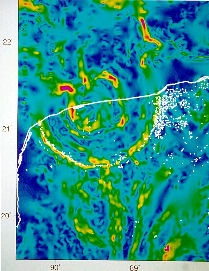
dépression circulaire limitée par une bordure abrupte connue dans le
golfe du Mexique grâce aux campagnes de prospection pétrolière et
notamment des mesures gravimétriques.http://www.ens-lyon.fr/Planet-Terre/Infosciences/Histoire/Evolution/Articles/limiteKT.html

Structures
concentriques du cratère du Chicxulub révélées par l'étude des anomalies
gravimétriques. Trait noir épais : côte nord du Yucatan et cercles
blancs : cénotes (trous remplis d'eau douce). votre commentaire
votre commentaire
-
http://www.cnrs.fr/Cnrspresse/n396/html/n396a06.htm#enca

Les
trapps du Deccan se sont mis en place au nord-ouest de la partie
péninsulaire de l'Inde, sur une partie du vieux socle précambrien
indien constitué de granites et de gneiss.
Le Deccan est l'une des provinces basaltiques les plus étendues
à la surface de la planète. votre commentaire
votre commentaire
-
Les cellules souches - embryonnaires, foetales, adultes
Les cellules souches ont deux qualités que ne possèdent pas les
autres cellules : leur capacité à se multiplier indéfiniment
en culture in vitro, aussi longtemps qu'elles sont laissées dans
un état indifférencié; et leur aptitude à se différencier
dès lors que leur sont proposés des facteurs adéquats.
Elles existent chez l'embryon, chez le foetus et son cordon ombilical, ou chez
l'individu né - qu'on qualifie alors ... d'adulte.Les cellules souches embryonnaires, localisées dans la masse cellulaire
interne du tout jeune embryon (voir schéma ci-dessous), sont exceptionnelles
en ce qu'elles participent à l'édification de tous les tissus
du futur individu. Cette totipotence les qualifient pour réparer
tous les tissus, et les rend aptes à livrer une information, pour l'instant
inégalée, sur le développement embryonnaire et son contrôle
génétique.
Pour leur part, les cellules souches foetales ou adultes, localisées
en petit nombre dans tous les tissus (dont elles assurent la maintenance), n'ont
pas une telle universalité : elles sont seulement multipotentes
même si elles se révèlent plus multipotentes qu'on
ne le pensait, comme l'étude des cellules souches du tissu adipeux l'a
montré.Les atouts du tissu adipeux adulte
Le tissu adipeux est aisé à prélever par liposuccion, et
un individu, même mince, peut en livrer facilement un litre.
Il contient des cellules souches, qui ont l'intérêt de se multiplier
plus vite que celles obtenues à partir d'autres tissus adultes comme
la moelle osseuse ou le cerveau par exemple.
Ces cellules souches se différencient in vitro en cellules adipeuses,
mais aussi en cellules musculaires, osseuses et même en cellules nerveuses,
ce qui n'était pas attendu puisque les cellules nerveuses dérivent
de l'épiderme alors que les cellules adipeuses proviennent du mésoderme.Chacun pourrait donc disposer de ces cellules pour une autogreffe réparatrice,
exempte de rejet. Et chacun pourrait les proposer, pour une allogreffe, à
qui serait porteur d'un défaut génétique interdisant l'autogreffe.Les études préliminaires menées chez la souris ont ouvert
cette voie.
Les chercheurs travaillant sur les cellules souches adultes du tissu adipeux
de souris ont, au cours de ce printemps, engrangé trois beaux succès
:- la réparation de fracture
On savait conduire, in vitro, la différenciation de cellules
souches adipeuses de souris en cellules cartilagineuses et osseuses. Michael
Longaker et son équipe, de l'université de Standford en Californie,
sont parvenus à le faire in vivo sur des souris : ils ont pratiqué,
chirurgicalement, une fracture trop large pour se réparer toute seule
sur laquelle ils ont appliqué des cellules souches adipeuses adultes,
disposées dans un polymère biodégradable d'apatite (un
constituant naturel des os). Les fractures des souris témoins ne faisaient
pas l'objet d'un tel traitement.Douze semaines plus tard, les cellules souches avaient comblé en se
différenciant 70 à 90% de la fracture des souris traitées.
Par comparaison, chez les souris témoins il n'était apparu qu'un
tissus désorganisé et qui plus est seulement dans moins de10%
des cas.Pour l'instant, les essais cliniques pratiqués chez les humains, pour
tenter de réparer les fractures graves, n'utilisent que des cellules
souches provenant de la moelle osseuse.- l'expression de protéines spécifiques du muscle cardiaque
On savait obtenir l'expression de protéines spécifiques du muscle
cardiaque (chaîne lourde de la myosine et troponine 1) à partir
de cellules souches adipeuses en culture in vitro. John Fraser et l'entreprise
de biotechnologie Macropore viennent de montrer qu'il était possible
de le faire in vivo : ils ont injecté chez des souris au myocarde
altéré, soit une simple solution saline, soit un million de cellules
souches adipeuses induites, c'est à dire auxquelles avaient été
fournis des facteurs de différenciation. Chez les souris du deuxième
groupe, et chez elles seules, le myocarde s'est mis à exprimer les deux
protéines spécifiques du muscle cardiaque.- la différenciation, in vitro : vers des cellules
nerveuses
Les chercheurs savaient obtenir in vitro des cellules qui ressemblent
à des cellules nerveuses à partir de cellules souches adipeuses
et d'un cocktail de facteurs de croissance et d'agents inducteurs.ces cellules fonctionnaient bien comme des cellules nerveuses
: elles expriment en effet des protéines spécifiques à
ces dernières comme des protéines réceptrices de neurotransmetteurs.Ainsi, le NMDA, une substance mimétique du neurotransmetteur glutamate,
a la particularité de faire mourir les cellules nerveuses lorsqu'il est
présent en trop grande quantité en produisant chez elles, une
fois lié à leurs récepteurs au glutamate, un effet bien
trop excitateur. Or, le NMDA a le même effet mortel sur les cellules souches
induites ce qui démontre qu'elles reçoivent son message; donc
qu'elles expriment à leur surface les récepteurs NMDA du glutamate
capables de le capter.L'étape suivante consistera à passer à l'étude
in vivo en introduisant dans un modèle animal de telles cellules
induites.
A la lumière de ces premiers résultats, il apparaît que
les cellules souches adultes du tissu adipeux, qui ont l'intérêt
d'être disponibles en quantité et de ne susciter aucun débat
éthique, sont promises à un bel avenir dans la reconstruction des
tissus dégradés ou perdus.Ces résultats montrent aussi que les tissus auxquels on peut espérer
aboutir sont de types plus variés que ceux vers lesquels s'orientent
naturellement ces cellules, dès lors qu'on saura leur fournir les facteurs
de différenciation adéquats.Mais, il existe des centaines de types de cellules différentes chez
l'homme, et il est fort peu probable que les seules cellules souches adipeuses,
ou même d'autres types de cellules souches adultes, suffiront pour obtenir
tous les types cellulaires . Un tel résultat ne semble accessible que
via un élargissement et une diversification des sources disponibles de
cellules souches.C'est ainsi que la Grande-Bretagne vient de créer en mai 2004 une banque
de cellules souches accessible aux chercheurs du monde entier, qui accueillera
et stockera tous les types de cellules souches qu'on aura su isoler, qu'elles
soient : embryonnaires, foetales ou adultes.Pour quelles recherches une telle banque de cellules pourra-t-elle être
exploitée ? On peut citer quelques pistes :- L'identification accélérée, et presque industrielle,
de facteurs de différenciation au moyen d'un système, aujourd'hui
disponible, de criblage et de détection comparable à celui des
biopuces. - L'établissement de lignées embryonnaires mutantes à
partir de tout jeunes embryons mis à l'écart dans le cadre de
la fécondation in vitro lorsqu'ils sont porteurs de mutations
délétères. Ces lignées devraient permettre de
mieux comprendre et de mieux soigner ces maladies génétiques,
et peut-être un jour de les guérir. - On a identifié chez la souris le gène-maître nanog
qui, actif dans les cellules souches embryonnaires, déclenche leur
multiplication indéfinie tout en interdisant leur différenciation.
Des cellules embryonnaires totipotentes, mises au contact du produit
de ce gène, pourraient donc bientôt fournir - et de façon
très économe car à partir d'un seul embryon - des millions
de leurs semblables. Et si l'on parvenait un jour à réactiver
ce gène chez des cellules souches adultes, elles seraient ramenées
à leur état totipotent, c'est à dire à
une nature de cellules embryonnaires et le problème éthique
soulevé par l'utilisation des embryons humains ne se poserait plus.
Les récents résultats de la recherche dans le domaine des cellules
souches permettent d'envisager leur utilisation prochaine dans un but thérapeutique.
Les limites de cette révolution médicale ne seront pas seulement
dictées par celles de la science mais aussi par des réponses aux
questions éthiques qu'elle soulève. Un débat faisant intervenir
tous les acteurs de la société est en cours, et la récente
mise au point législative sur le sujet n'en marque pas le terme. Nul
doute que dans le domaine de l'utilisation des cellules souches, les limites
du possible continueront à être définies en fonction du
progrès des connaissances, mais aussi de l'évolution de la société.http://www.snv.jussieu.fr/vie/bib/dos-doc/1documents.htm
 votre commentaire
votre commentaire Suivre le flux RSS des articles
Suivre le flux RSS des articles Suivre le flux RSS des commentaires
Suivre le flux RSS des commentaires
- L'identification accélérée, et presque industrielle,
Mon petit cahier de sciences naturelles






