-
Par trichard le 20 Septembre 2006 à 14:45
18.. - La mutation Antennapedia
donne des mouches qui ont des pattes sur la tête à la
place des antennes.1894 - William Bateson utilise le terme "homeosis"
pour la première fois pour désigner le phénomène
de transformation d'un organe en un autre. L'existence de mutations
homéotiques révèle qu'il existe des gènes
sélectionnant le destin des cellules lors du développement.1927 - Calvin Bridges a découvert la mutation bithoraxoïd
(bxd) qui a pour effet de donner à une partie du
premier segment abdominal l'aspect du troisième segment
thoracique. De telles mouches mutantes peuvent avoir une paire de
pattes supplémentaires.1941 - Calvin Bridges isola également un mutant qu'il nomma
bithorax (bx). Ce mutant a une
paire de balanciers anormaux : la partie antérieure de ces
organes est remplacée par du tissu d'aile. La moitié
antérieure du troisième segment thoracique est en fait
transformée en moitié antérieure du second
segment thoracique.1954 - Lewis, découvrit un mutant qu'il nomma postbithorax
(pbx). Chez ce dernier, c'est la partie postérieure
des balanciers, des pattes, et en fait la partie postérieure
de tout le troisième segment qui a les caractéristiques
du second.- Chez le mutant ultrabithorax (ubx)
, découvert par Calvin Bridges, le troisième segment
thoracique et le premier segment abdominal ont des caractéristiques
du second segment thoracique. Les mouches qui présentent cette
mutation n'atteignent pas l'âge adulte.1978 - Lewis localise sur le chromosome 3 de la drosophile deux
groupes de gènes homéotiques : le complexe
Antennapediale et le complexe Bithorax .Le complexe Antennapedia contient
les gènes homéotiques labial (lab) et deformed (Dfd)
qui spécifient les segments céphaliques, tandis que Sex
comb reduced (Scr) et Antennapedia (Antp) participent à
l'établissement de l'identité des segments thoraciques,
et le gène proboscipedia (pb) qui semble n'agir que dans les
adultes ; toutefois, en son absence, les palpes labiaux de la bouche
sont transformés en pattes.Le complexe Bithorax comporte
trois gènes : le gène Ultrabithorax (ubx) qui est
nécessaire à l'identité du troisième
segment thoracique ; les gènes abdominal A (abdA) et abdominal
B (abdB) qui sont responsables de l'identité segmentaire des
segments abdominaux.Lewis a également découvert que l'ordre des gènes
homéotiques du complexe Bithorax sur le chromosome 3
correspond à l'ordre dans lequel ils sont activés le
long de l'axe antéro-postérieur du corps.1983 - isolement et analyse de plusieurs
gènes homéotiques chez la drosophile,
repérage, dans leur structure, d'une séquence commune
de 180 paires de bases qualifiée d'homéobox ou
homéoboîte. Les gènes homéotiques
codent pour des protéines qui régulent l'activité
d'autres gènes.1984 - L'homéoboîte d'abord mise en évidence
chez la drosophile a ensuite été découverte chez
des Vertébrés, dont le Xénope- Les similitudes constatées entre les homéoboîtes
des différentes espèces ont révélé
que l'homéoboîte sert des fonctions voisines ou
identiques chez les Insectes et chez les Vertébrés.
La même concordance entre l'organisation des gènes sur
les chromosomes et leur ordre d'expression a été
retrouvée chez la Souris et chez l'homme. Il a été
découvert chez les Mammifères
quatre groupes de gènes homéotiques , nommés
complexes HOX et situés
chacun sur un chromosome différent.1986 - La "paired box",
codant pour une deuxième région de la protéine
et également capable de se fixer sur l'ADN de gènes-cibles,
a été mise en évidence dans trois gènes
gouvernant la segmentation de l'embryon chez la drosophile.199' - exp de transgenèse (Gruss, 1991 ; Capecchi, 1993)
ont été réalisées et ont permis de
démontrer que les gènes
homéotiques chez la souris et chez la drosophile ont la même
fonction : déterminer la mise en place des organes de l'avant
à l'arrière du corps.1991 - le gène Smalleye (conduit
à la réduction de la taille des yeux) de la Souris et
le gène de l'aniridie (conduit chez les hétérozygotes
à de petits yeux dépourvus d'iris) humaine ont été
isolés et analysés. Ces gènes possèdent à
la fois une homéoboîte et une "paired box",
codant pour une deuxième région de la protéine
et également capable de se fixer sur l'ADN de gènes-cibles.
Il existe ainsi une famille de gènes
Pax, contenant une paired box, par analogie avec la famille Hox de
gènes contenant l'homéoboîte. Dans
cette nomenclature, les mutations Smalleye chez la souris et aniridia
chez l'homme sont des mutations du gène Pax6.1993 - Eyeless : un gène
homologue de Pax 6 a été isolé chez la
drososphile.1994 - il a été démontré
que Pax 6 est affecté par les mutations Eyeless. Les gènes
Pax6 (souris, homme) et Eyeless (drosophile) sont alors homologues.
Ainsi, l'oeil des Mammifères et l'oeil des Insectes, bien que
différents dans leur structure, requièrent pour leur
développement un même gène homéotique. En
1994, des expériences ont révélé que le
gène Eyeless est un gène
"maître" de la formation de l'oeil,
c'est-à-dire contrôlant toute
la cascade génétique du développement
de l'oeil. Depuis, des gènes maîtres homologues de
Eyeless et Small eye ont été trouvés chez divers
autres taxons (planaire, ver némerte, calmar, ascidie).La constance des structure et
fonction des complexes de gènes du développement
découverts à ce jour suggère fortement que les
mécanismes fondamentaux gouvernant la détermination de
l'identité régionale le long des axes embryonnaires se
sont bien conservés au cours de l'évolution.http://www.inrp.fr/Acces/biotic/develop/controle/html/histgen.htm
Les homéodomaines et la reconnaissance spécifique
de l'ADNIl existe une grande variété de protéines interagissant
avec l'ADN. Certaines se fixent au niveau du grand sillon tandis que d'autres
se fixent au niveau du petit sillon de la double hélice d'ADN. Quelques
protéines réclament pour se fixer à l'ADN la présence
d'un ligand sous forme d'ion métallique. Les protéines qui
interagissent avec l'ADN ont des fonctions variées telles que facteur
de transcription, répresseur, etc., mais la fonction de nombreuses
protéines est encore inconnue.
L'homéodomaine est un motif peptidique
de fixation sur l'ADN, composé d'une soixantaine d'acides aminés
codés par 180 paires de bases composant l'homéoboîte
des gènes homéotiques. Cet homéodomaine n'est qu'une
petite partie des protéines codées par les gènes homéotiques.On retrouve ces homéodomaines extrêmement conservés
dans de très nombreuses espèces allant des bactéries
aux mammifères. L'homéodomaine du gène Hox-A7 de
l'homme ne diffère que par un seul acide aminé de l'homéodomaine
du gène Antennapedia de la Drosophile, ce qui implique une
pression sélective extrêmement forte sur ces homéodomaines.Il existe une grande unité structurale entre les différents
homéodomaines : en effet, ils sont pratiquement tous constitués
par 3 hélices alpha et parfois par une quatrième au niveau
de l'extrémité C-terminale.La reconnaissance spécifique d'une partie de l'ADN par l'homéodomaine
est principalement assurée par 4 résidus en position 47,
50, 51 et 54 qui entrent en contact avec les bases du grand sillon de l'ADN.
Quelques données montrent une interaction au niveau du petit sillon
de résidus de l'extrémité N-terminale.http://www.inrp.fr/Acces/biotic/develop/controle/html/homeodom.htm
 votre commentaire
votre commentaire
-
Par trichard le 20 Septembre 2006 à 11:23
III- Développement du cortex cérébral
1 - Chez la souris normale
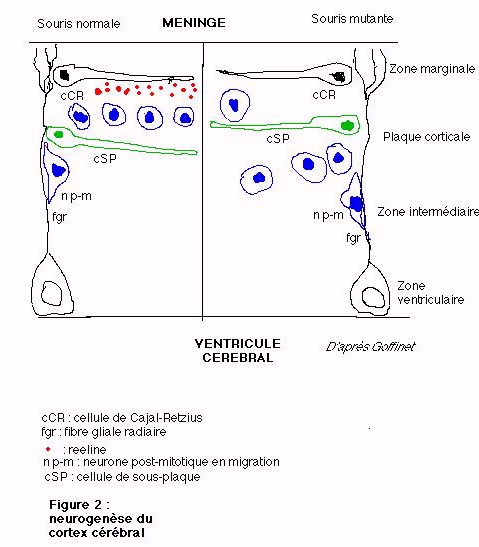
Dès le stade fœtale, une préplaque
corticale composée des premiers neurones postmitotiques engendrée
au sein des zones ventriculaires, se met en place. Ces cellules migrent
ensuite le long de fibres gliales radiaires, jusqu'à la surface
méningée et deviennent soit des cellules de Cajal-Retzius
(cCR) soit des cellules de la sous-plaque (SP). La plupart de ces cellules
disparaîtront lorsque les neurones de la plaque corticale se mettront
en place entre la couche des cCR (désormais située dans la
zone marginale) et de la SP. Enfin la plaque corticale se transformera
en substance grise du cortex définitif (décrite au dessus).La neurogenèse de la plaque corticale se
réalise donc selon un gradient intéro-externe de migration
amenant les derniers neurones formés dans les zones ventriculaires
à occuper toujours au terme de leur migration, l'interface entre
la couche marginale et la plaque corticale. Le développement de
cette plaque est très important car il est à l'origine des
six couches du cortex mature; la zone ventriculaire ne constituant plus
à la fin des processus de corticogenèse qu'une couche unique
de cellules épendymaires qui limite les ventricules cérébraux.La reeline, protéine extracellulaire sécrétée
par les cCR est déterminante dans la mise en place des couches de
neurones juxtaposés selon ce gradient intéro-externe. Ce
rôle dans la corticogenèse pourrait être une action
répulsive, empêchant les neurones en migration de pénétrer
dans la zone marginale riche en reeline respectant ainsi la stratification
normale du cortex mature (figure 2). Malgré le rôle essentiel
de cette protéine dans la corticogenèse, elle n'est qu'un
maillon important de la cascade des interactions moléculaires présidant
à la mise en place des couches corticales.2 - Chez la souris homozygote reeler
Chez l'embryon de la souris homozygote reeler,
la migration des neurones se déroule normalement jusqu'au moment
où ceux-ci arrivent près de leur destination. La reeline
n'étant pas sécrétée dans la matrice extracellulaire
par les cellules de Cajal-Retzius, le gradient répulsif vis-à-vis
des neurones de la plaque corticale n'a pas lieu si bien que les cellules
de la sous-plaque sont comme repoussées vers l'extérieur
(figure 2) en dehors de la plaque corticale sous-jacent très désorganisée.
Cela se traduit chez l'animal très précocement par un cortex
où les couches sont peu apparentes (figure 1b) : la plaque corticale
ne s'intercale plus dans la préplaque et le gradient de mise en
place des neurones pyramidaux se fait de manière quasiment inversée
c'est-à-dire selon un gradient extéro-interne.Remarque : dans des
zones cérébrales où la reeline est très exprimée
chez la souris normale, son absence chez le mutant reeler n'entraîne
pas de perturbation importante, c'est notamment le cas pour le bulbe olfactif
mais pas pour le cervelet (voir ci-dessous).IV - Développement du cortex cérébelleux
1 - Chez la souris normale
Dans le cortex cérébelleux, le rôle
joué par les cellules de Cajal-Retzius dans le cortex cérébral
en formation, serait joué par les cellules granulaires externes.
En effet, ces cellules sécréteraient la reeline dans la matrice
extracellulaire qui aurait un rôle répulsif dans la zone marginale
repoussant la plaque des cellules de Purkinje à l'interface de la
couche moléculaire et de la couche granulaire.2 - Chez le mutant homozygote reeler
Dans le cortex cérébelleux où
la reeline est pourtant peu exprimée, la modification de la séquence
nucléotidique de cette protéine entraîne de grandes
perturbation dans l'organisation du cortex cérébelleux chez
le mutant homozygote. Chez ce mutant, les cellules de Purkinje sont disposées
de manière aléatoire vraisemblablement à cause d'un
arrêt de leur migration si bien que le cervelet paraît constitué
de l'emboîtement de deux structures : à l'extérieur,
un cortex cérébelleux dont l'architecture est semblable à
celle que l'on trouve chez l'animal normal mais très mince et à
l'intérieur une masse cellulaire comportant la plupart des cellules
de Purkinje mélangées aux cellules des noyaux profonds. Faire
un renvoi vers les photos et la synthèse correspondant à
cette partie.3 - Chez d'autres mutants cérébelleux
Les précurseurs des cellules granulaires
du cortex cérébelleux, localisés dans la couche moléculaire
superficielle, mettent d'abord en place leurs axones (futures fibres parallèles)
avant que leurs corps cellulaires ne migre vers leur position définitive
dans la couche granulaire où elles contacteront les fibres moussues.Chez la souris mutante weaver (qui comme le reeler
et le staggerer présente des modifications du phénotype à
l'échelle clinique et moléculaire), les cellules précurseurs
des grains meurent durant les deux premières semaines postnatales
avant qu'elles n'aient pu migrer dans la couche granulaire interne et former
leurs fibres parallèles. Secondairement à la mort cellulaire
massive des cellules précurseurs des grains, les fibres moussues
ne trouvant plus leur cible forment alors des synapses avec les cellules
de Purkinje. Cette mutation est donc à l'origine de la désorganisation
des circuits neuroniques par disparition de leur cible.Il en est de même pour le mutant homozygote
staggerer chez qui les cellules précurseurs des cellules granulaires
migrent vers la couche moléculaire mais disparaissent presque totalement
un mois après la naissance à cause de la mort de leur cible,
les cellules de Purkinje.Outre l'intérêt des mutants cérébelleux
dans la diversité des phénotypes, ces trois mutants (staggerer,
weaver et reeler) sont à l'état homozygote de bons modèles
pour étudier l'implication du génotype dans la mise en place
des réseaux neuroniques et par voie de conséquence du fonctionnement
du système nerveux.
http://www.inrp.fr/Acces/biotic/gpe/dossiers/mutcer/html/neurogenese.htm
 votre commentaire
votre commentaire Suivre le flux RSS des articles de cette rubrique
Suivre le flux RSS des articles de cette rubrique Suivre le flux RSS des commentaires de cette rubrique
Suivre le flux RSS des commentaires de cette rubrique
Mon petit cahier de sciences naturelles



